- 半岛官方网页 ,20年外贸进出口代理服务经验。
- 服务热线:139 1787 2118
2023年6月26日,韩国食品药品安全部(MFDS)向WTO报送G/TBT/N/KOR/1150号通知,计划对《生物制剂等品种许可、审查规定》进行修订。修订目标是为了进一步加强国内生物制剂的安全。截至2023年8月25日,此修订正在征求意见阶段。
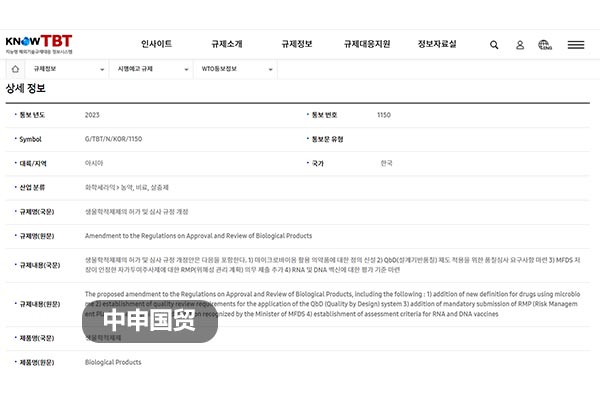
我国是全球第二大生物制剂市场,且相关产品的出口规模逐年递增,仅2022年我国对韩国出口医药产品就达到了12.57亿美元。当前韩国为我国”西药制剂”第一出口大国,因此此次修订对我国出口企业影响重大。建议出口企业应高度关注此次修订的内容更改,及时调整产品策略,避免后续出口产生不必要的贸易损失。
修订内容概述:
(1)新词义定义:为新出现的活菌制剂等名词定义;
(2)质量体系审查要求:制定了适用于设计质量体系(QbD)的质量审核要求(方案第4条、第26条);
(3)”科学论文引用索引”范围扩大:扩大了被认定为药理作用和临床试验效果资料的”科学论文引用索引”范围(方案第7条);
(4)改善稳定性试验资料的提交条件:对变更制造方法时,改善稳定性试验资料的提交条件进行了更改;
(5)风险管理计划提交程序:对于MFDS认可的自行注射产品,新增了强制性提交风险管理计划(RMP)的程序;
(6)RNA和DNA疫苗评价标准:建立了RNA和DNA疫苗评价标准。
相关推荐
联系我们
电话:139-1787-2118
邮箱:service@sh-zhongshen.com
邮箱:service@sh-zhongshen.com
相关推荐
微信联系

© 2025. All Rights Reserved.沪ICP备2023007705号-2 沪公网安备31011502009912号
沪公网安备31011502009912号








