- 半岛官方网页 ,20年外贸进出口代理服务经验。
- 服务热线:139 1787 2118
在过去的几年里,巴西的医疗器械产业不断发展,已经成为了拉丁美洲最大的医疗器械市场。对于出口商来说,了解巴西医疗器械的准入法规至关重要。本文主要从巴西医疗器械立法机构、医疗器械的分类,以及医疗器械产品的市场准入等方面进行深入剖析。
巴西医疗器械立法及主管机构
巴西医疗器械监管的基本法规是RDC185/01。该法规由国家卫生监督局(ANVISA)负责执行。ANVISA是巴西的主要监管机构,负责审批和监督医疗产品的市场准入。
巴西医疗器械的分类
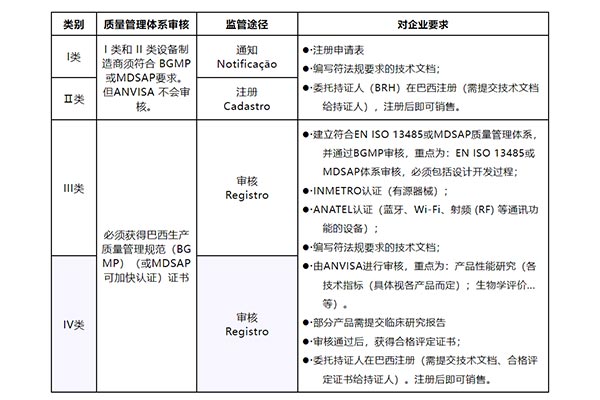
在巴西,医疗器械按照风险等级被分类为四个级别,分别是Ⅰ、Ⅱ、Ⅲ 和Ⅳ类。Ⅰ类代表最低风险,而Ⅳ类代表最高风险。医疗器械的分类规则在RDC185法规的附录II中有详细规定。
巴西医疗器械产品的市场准入
巴西对于任何涉及人体的产品(包括药品、医疗器械、美容化妆品等)的经营都有严格的规定。出口商在销售这些产品前,必须向巴西卫生部提交书面申请,并通过官方指定的注册持证人提供注册材料。这些材料必须以葡萄牙语为主要语言。
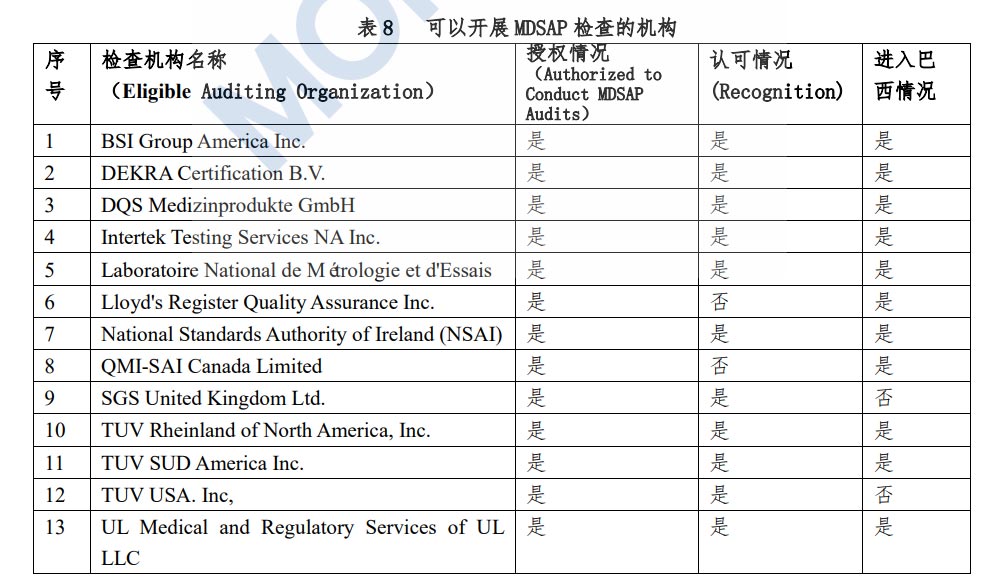
具有动力源的医疗器械产品需要通过认证。认证过程由第三方机构执行,其将对产品进行检测,并对生产工厂进行审核。对于风险较高的III类和IV类医疗器械,制造商可以选择使用MDSAP(医疗器械单一审核程序)审核来替代ANVISA的审核。值得注意的是,巴西目前已经公布了11家获得授权的MDSAP检测机构。
(1)什么是MDSAP
MDSAP全称Medical Device Single AuditProgram(医疗器械单一审核程序),是国际医疗器械监管者论坛IMDRF的MDSAP监管机构委员会发起的。MDSAP也就是我们俗称的五国联审,是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审核程序。
(2)ANVISA注册流程
对于想在巴西市场销售医疗器械的非本土生产商,需要按照ANVISA的规定进行认证和注册。基本的步骤和流程包括确定产品类别,指定巴西注册持有人(BRH),进行INMETRO认证,BGMP验厂,准备技术文档,支付申请费用,并最终获得批准销售。
(3)巴西出口医疗器械的上市许可所适用的主要法规
在巴西,医疗器械的上市许可需要遵守若干主要法规,这些法规包括医疗器械的准入法规RDC 185/2001和RDC 40/2015,以及临床试验法规RDC 10/2015和医疗器械制造商的GMP法规RDC 183/2017。
巴西的医疗器械市场虽然巨大,但是市场准入的法规也相对复杂。对于想在巴西市场销售产品的出口商来说,理解和遵守这些法规是非常重要的。这不仅可以确保他们的产品能够合规上市,也有助于减少可能的法律风险和不必要的成本。
相关推荐
联系我们
邮箱:service@sh-zhongshen.com
相关推荐
微信联系

© 2025. All Rights Reserved.沪ICP备2023007705号-2 沪公网安备31011502009912号
沪公网安备31011502009912号